以下我将从政策的重要性、核心框架、主要内容、面临的挑战以及未来趋势等多个维度,为您全面梳理“人工智能与医疗结合政策”这一主题。

为什么需要专门的政策?
AI医疗的快速发展带来了前所未有的机遇,但也伴随着一系列风险和挑战,政策的制定旨在:
- 规范市场秩序:防止“劣币驱逐良币”,确保市场上的AI医疗产品是有效、安全、可靠的。
- 保障患者安全:AI的决策错误可能导致严重的医疗事故,政策必须建立严格的准入和监管机制。
- 保护数据隐私:医疗数据是最高级别的敏感个人信息,政策需明确数据采集、使用、存储和共享的边界。
- 促进公平可及:避免AI技术加剧医疗资源分配不均,确保技术红利能惠及所有人群。
- 引导技术创新:通过明确的审批路径、资金支持和伦理指南,鼓励企业进行有价值的研发。
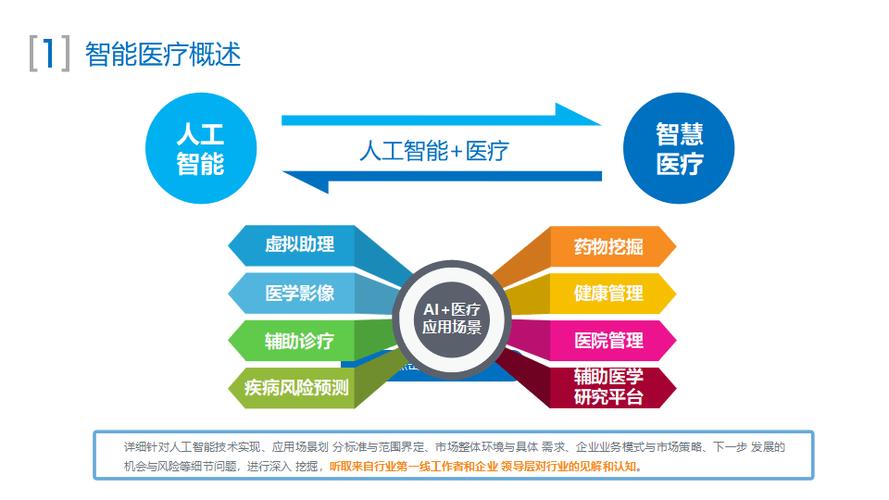
AI医疗政策的核心框架与主要内容
一个完善的AI医疗政策体系通常包含以下几个层面:
法律法规与伦理准则
这是政策的顶层设计,确立基本原则和底线。
-
法律法规:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 数据安全法:明确规定医疗数据作为重要数据的处理规则,要求数据控制者采取必要的安全措施。
- 个人信息保护法:特别是针对“健康医疗信息”这一敏感个人信息,要获得个人的“单独同意”,并赋予患者对其数据的知情权、决定权、查阅权、更正权和删除权。
- 医疗器械监督管理条例:将AI医疗软件(特别是作为医疗器械使用的)纳入其监管范围,这是最核心的监管法律依据。
- 网络安全法:确保AI医疗系统的网络安全,防止数据泄露和系统被攻击。
-
伦理准则:
- 患者为本:AI的应用必须以患者的最佳利益为出发点。
- 公平公正:避免算法偏见,确保AI系统对不同性别、种族、地域的患者都一视同仁。
- 透明可释:AI的决策过程应尽可能透明,尤其是在高风险场景下,需要有可解释性,以便医生理解和追溯。
- 责任明确:当AI辅助决策导致不良后果时,责任如何界定(是医生、医院还是开发者),必须有清晰的规定。
- 安全可控:AI系统必须经过充分验证,确保其在各种情况下都是稳定和安全的。
审批与监管机制
这是确保AI医疗产品“能上市、能用好”的关键环节。
-
分类管理:根据AI医疗产品的风险等级进行分类,中国NMPA(国家药品监督管理局)将其分为:
- 第三类医疗器械:最高风险,用于疾病诊断、治疗等关键环节,如AI辅助诊断软件(肺结节、糖网病等),需要经过严格的临床试验和审批流程。
- 第二类医疗器械:中等风险,如手术导航系统、康复训练设备等。
- 第一类医疗器械:较低风险,如AI健康管理APP。
-
“真实世界数据”应用:考虑到AI模型需要大量数据进行训练和优化,政策开始探索利用“真实世界数据”来支持产品的审批和上市后监管,这大大加速了创新产品的落地速度。
 (图片来源网络,侵删)
(图片来源网络,侵删) -
动态监管:AI模型不是一成不变的,它会不断学习新数据而产生“漂移”,政策要求对已上市的产品进行持续的上市后监测和性能评估,确保其在整个生命周期内都保持安全有效。
数据治理与安全
这是AI医疗的“燃料”和“命脉”。
- 数据确权与授权:明确个人对其医疗数据的所有权,以及医疗机构、研究机构和企业使用数据的权利和义务。
- 数据标准化:推动医疗数据的格式和接口标准化,打破“信息孤岛”,促进数据在合法合规下的流动和共享。
- 隐私计算技术:鼓励和规范使用联邦学习、多方安全计算、差分隐私等技术,实现“数据可用不可见”,在保护隐私的前提下进行模型训练。
- 数据跨境流动:对于涉及国际合作的研发,需制定明确的数据出境安全评估和审批机制。
技术创新与产业扶持
政策不仅是“管”,更是“促”。
- 资金支持:通过政府引导基金、科研项目(如“科技创新2030”重大项目)等方式,支持AI医疗基础理论和关键核心技术的研发。
- 人才建设:鼓励高校设立AI+医疗交叉学科,培养既懂医学又懂AI的复合型人才。
- “监管科学”建设:投入资源研究如何更科学、更高效地监管AI这类快速迭代的技术,例如开发新的审评工具、验证方法和标准。
- 应用场景开放:在确保安全的前提下,鼓励在智慧医院、基层医疗、公共卫生、新药研发等领域开展AI应用的试点示范。
人才培养与公众教育
- 医生培训:将AI知识纳入医学继续教育,使医生能够理解、信任并有效使用AI工具。
- 公众科普:向公众普及AI医疗的原理、优势、局限性和风险,建立合理的期望,提升社会对AI医疗的接受度。
面临的主要挑战
- “监管滞后”于“技术迭代”:AI技术日新月异,而法律法规的制定和修改周期较长,容易导致监管空白。
- “算法黑箱”与“可解释性”矛盾:深度学习模型效果虽好,但其决策过程难以解释,这与医疗领域对透明度的要求存在天然冲突。
- “数据孤岛”与“数据饥渴”的矛盾:医疗机构之间数据不互通,而高质量的AI模型需要海量、多中心的标注数据。
- 责任界定难题:当AI辅助诊断出现漏诊或误诊时,责任链条长,涉及医生、医院、软件开发商、数据提供方等,界定困难。
- 全球监管标准不统一:不同国家和地区对AI医疗的监管路径和要求存在差异,给跨国企业带来了合规挑战。
全球政策趋势与展望
- 从“产品审批”转向“全生命周期管理”:监管的重心不再仅仅是上市前的审批,而是覆盖数据、算法、临床应用、上市后监测和退市的整个生命周期。
- “沙盒监管”模式推广:设立“监管沙盒”,允许创新企业在受控环境中测试其产品,监管机构全程观察,及时发现并解决问题,这是一种平衡创新与安全的有效方式。
- 强调“以人为本”的AI:政策越来越注重AI的人文关怀,确保技术增强而非取代医患关系,提升患者的就医体验和获得感。
- 加强国际合作:在AI医疗伦理、数据标准、审批互认等方面,各国正在加强对话与合作,共同应对全球性挑战。
- 聚焦“可信AI”:未来的政策将更加关注AI的鲁棒性、公平性、隐私保护和安全性,推动构建“可信AI”体系。
人工智能与医疗的结合政策是一个复杂的系统工程,它需要在鼓励创新与防范风险、促进发展与保障安全之间找到精妙的平衡,一个成功的政策体系,应当像一位智慧的“导航员”,既为AI医疗这艘巨轮指明前进的方向,又为其设置坚固的“安全护栏”,最终目标是让这项革命性技术真正服务于全人类的健康福祉。
标签: AI医疗政策落地路径 医疗AI政策实施难点 AI医疗落地政策支持